В книгах, но не в реальной жизни
Дифтерия долго свирепствовала на Земле, унося жизни и детей, и взрослых. К счастью, благодаря всемирной вакцинации, многие ни разу в жизни не видели больного дифтерией и даже забыли о том, что такая болезнь бывает. До окончательной победы еще далеко, но мы уверены: наступит день, когда дифтерия останется только в книгах. А для этого не забывайте прививаться от дифтерии каждые десять лет.
- Victor J. Freeman. (1951). STUDIES ON THE VIRULENCE OF BACTERIOPHAGE-INFECTED STRAINS OF CORYNEBACTERIUM DIPHTHERIAE. J Bacteriol. 61, 675-688;
- Victor J. Freeman, I. Una Morse. (1952). FURTHER OBSERVATIONS ON THE CHANGE TO VIRULENCE OF BACTERIOPHAGE-INFECTED AVIRULENT STRAINS OF CORYNEBACTERIUM DIPHTHERIAE. J Bacteriol. 63, 407-414;
- Pappenheimer A.M. Jr. (1980). Diphtheria: studies on the biology of an infectious disease. Harvey lectures. 76, 45–73;
- Fatemeh Shafiee, Marc G. Aucoin, Ali Jahanian-Najafabadi. (2022). Targeted Diphtheria Toxin-Based Therapy: A Review Article. Front. Microbiol.. 10;
- Andreas Sing, Regina Konrad, Dominik M. Meinel, Norman Mauder, Ingo Schwabe, Reinhard Sting. (2022). Corynebacterium diphtheriae in a free-roaming red fox: case report and historical review on diphtheria in animals. Infection. 44, 441-445;
- Scientists provide first evidence of diphtheria-like infectious agent in hedgehogs. (2022). ScienceDaily;
- Chihiro Katsukawa, Takako Komiya, Kaoru Umeda, Minami Goto, Tokuma Yanai, et. al.. (2022). ToxigenicCorynebacterium ulceransisolated from a hunting dog and its diphtheria toxin antibody titer. Microbiol Immunol. 60, 177-186;
- Dominik M. Meinel, Regina Konrad, Anja Berger, Christina König, Torsten Schmidt-Wieland, et. al.. (2022). Zoonotic Transmission of ToxigenicCorynebacterium ulceransStrain, Germany, 2022. Emerg. Infect. Dis.. 21, 356-358;
- Aron J. Hall, Pamela K. Cassiday, Kathryn A. Bernard, Frances Bolt, Arnold G. Steigerwalt, et. al.. (2022). NovelCorynebacterium diphtheriaein Domestic Cats. Emerg. Infect. Dis.. 16, 688-691;
- «Диагностика, лечение и профилактика острого тонзиллита и дифтерии в вооруженных силах Российской Федерации». (2022). Министерство обороны РФ;
- Shaun A Truelove, Lindsay T Keegan, William J Moss, Lelia H Chaisson, Emilie Macher, et. al.. (2020). Clinical and Epidemiological Aspects of Diphtheria: A Systematic Review and Pooled Analysis. Clinical Infectious Diseases. 71, 89-97;
- A. Sing, S. Bierschenk, J. Heesemann. (2005). Classical Diphtheria Caused by Corynebacterium ulcerans in Germany: Amino Acid Sequence Differences between Diphtheria Toxins from Corynebacterium diphtheriae and C. ulcerans. Clinical Infectious Diseases. 40, 325-326;
- A M Pappenheimer. (1977). Diphtheria Toxin. Annu. Rev. Biochem.. 46, 69-94;
- Ющук Н.Д. и Кулагина М.Т. (1997). Дифтерия: клиническое течение, диагностика и лечение. «РМЖ». 4;
- Linton D.S. Emil Von Behring: infectious disease, immunology, serum therapy. American Philosophical Society, 2005. — 580 p.;
- Первый «медицинский нобель»;
- Столбнячная палочка: токсична и смертельно опасна;
- Коклюш: кашель, который убивает;
- Erika Hammarlund, Archana Thomas, Elizabeth A. Poore, Ian J. Amanna, Abby E. Rynko, et. al.. (2022). Durability of Vaccine-Induced Immunity Against Tetanus and Diphtheria Toxins:
A Cross-sectional Analysis. Clinical Infectious Diseases. 62, 1111-1118; - Вакцинация для взрослых. Как и зачем;
- Roni Nasser, Stav Rakedzon, Yaakov Dickstein, Amjad Mousa, Ido Solt, et. al.. (2020). Are all vaccines safe for the pregnant traveller? A systematic review and meta-analysis. Journal of Travel Medicine. 27;
- Artur Galazka. (2000). The Changing Epidemiology of Diphtheria in the Vaccine Era. J INFECT DIS. 181, S2-S9;
- N. P. Galina, A. Ya. Mindlina, R. V. Polibin. (2020). Surveying children and adult vaccination program against diphtheria, tetanus, measles and viral hepatitis B in the Russian Federation. iimm. 9, 779-786;
- Ricardo A. Strauss, Laura Herrera-Leon, Ana C. Guillén, Julio S. Castro, Eva Lorenz, et. al.. (2021). Molecular and epidemiologic characterization of the diphtheria outbreak in Venezuela. Sci Rep. 11;
- Badell E., Alharazi A., Criscuolo A., The NCPHL diphtheria outbreak working group, Lefrancq N., Bouchez V. et al. (2020). Epidemiological, clinical and genomic insights into the ongoing diphtheria outbreak in Yemen. medRxiv;
- Edgar Badell, Abdulilah Alharazi, Alexis Criscuolo, Khaled Abdullah Ali Almoayed, Noémie Lefrancq, et. al.. (2021). Ongoing diphtheria outbreak in Yemen: a cross-sectional and genomic epidemiology study. The Lancet Microbe;
- Fekri Dureab, Maysoon Al-Sakkaf, Osan Ismail, Naasegnibe Kuunibe, Johannes Krisam, et. al.. (2022). Diphtheria outbreak in Yemen: the impact of conflict on a fragile health system. Confl Health. 13;
- Вакцинация перед школой: гайд для родителей;
- Declan Butler. (2022). Close but no Nobel: the scientists who never won. Nature;
- Naresh Chand Sharma, Androulla Efstratiou, Igor Mokrousov, Ankur Mutreja, Bhabatosh Das, Thandavarayan Ramamurthy. (2022). Diphtheria. Nat Rev Dis Primers. 5.
Как человек заболевает туберкулезом?
Передача возбудителя туберкулеза осуществляется воздушно-капельным путем. При кашле или чихании, разговоре или пении капельки слюны больного легочной формой инфекции вместе с бактериями попадают в воздух, и находящийся рядом здоровый человек может их вдохнуть. В связи с этим туберкулез часто бывает распространен в густонаселенных районах (видео 1).
В группу риска входят дети до 5 лет, молодые люди в возрасте 14–20 лет и пожилые, наркоманы, алкоголики, люди с хроническими заболеваниями (сахарный диабет, силикоз, болезни почек и т.д.), онкологией и сниженным иммунитетом (в том числе, из-за ВИЧ), а также представители некоторых профессий (медработники, сотрудники приютов для бездомных, исправительных учреждений, домов для престарелых) и бездомные [8].
CDC отмечают, что туберкулез легких не передается через рукопожатия, общие еду, напитки, постельное белье, зубные щетки и даже поцелуи. Развитие самой распространенной формы болезни — туберкулеза легких — происходит в три стадии (рис. 7).
Сначала бактерии туберкулеза попадают в легкие, где медленно делятся и, пока их немного, остаются почти незаметными для иммунной системы. Туберкулез чаще поражает верхние доли легких, чем нижние, причина этого неясна. В самой ранней фазе инфекции туберкулезная палочка привлекает внимание клеток врожденного иммунитета — фагоцитов (в первую очередь, нейтрофилов и макрофагов), способных поглощать чужеродные бактерии и вирусы.
Они захватывают бактерии извне, образуя фагосомы, после чего фагосомы сливаются с лизосомами, помогающими переварить врага . Если вирулентность бактерии невысока, то на этом ее жизнь заканчивается. Однако часто микобактерии беспрепятственно размножаются внутри фагоцитов благодаря специальным веществам, мешающим лизосомам сливаться с фагосомами. В этом случае зараженные фагоциты погибают, а микобактерии выходят наружу.
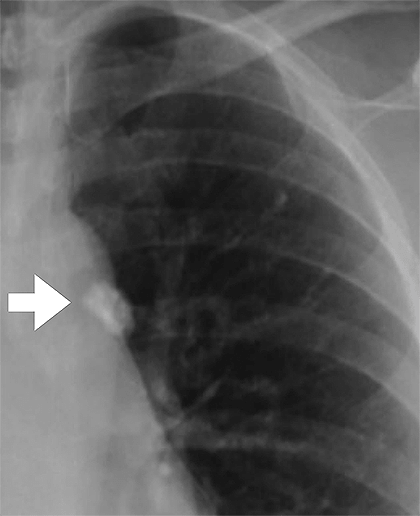
Рисунок 8. Гранулема на рентгеновском снимке грудной клетки. Бледное пятно различимо из-за того, что там откладываются соли кальция. Гранулема представляет собой капсулу с макрофагами, бактериями и соединительной тканью. В течение жизни гранулема может прорваться, и тогда туберкулез перейдет в активную форму.
Wikipedia
Когда макрофаги разрушаются, из них вытекают ферменты, повреждающие ближайшие клетки легкого. Если сразу разрушилось достаточно много макрофагов, в легких наблюдаются очаги распадающейся ткани, воспаление, а также туберкулы — узелки, где больше всего палочек Коха.
На этой стадии заболевания иммунитет все еще может сдерживать инфекцию посредством образования гранулем. Часто, если человек заболел впервые в жизни, у него образуется одна гранулема размером с вишню, которую видно на рентгеновском снимке (рис. 8). Это первичное поражение легких при туберкулезе называют очагом Гона по имени профессора Антона Гона, впервые описавшего его в 1912 году [9], [10].
В большинстве случаев гранулема не перерастает в полноценный туберкулез и зарубцовывается, образуя капсулу с макрофагами (где по-прежнему могут продолжать жить микобактерии) и соединительной тканью. Инфекция в гранулеме сохраняется пожизненно, а это таит в себе риск активации туберкулеза в любой момент.
Например, у героя операции в Перл-Харборе летчика Ричарда Беста латентный туберкулез «активизировался» из-за вдыхаемых им едких паров в самолете. Он вылечился, но стал инвалидом на всю оставшуюся жизнь. Поразительно, но зажившие очаги Гона встречаются у 97% трупов взрослых людей. Учитывая это, становится очевидным, что в ближайшее время туберкулез вряд ли удастся победить [11].
В 10% случаев иммунная система не в состоянии сдержать инфекцию. В этом случае гранулема прорывается, и микобактерии выходят на волю. Риск этого выше у людей со сниженным иммунитетом, например, у больных СПИДом и пациентов, проходящих иммуносупрессивную терапию.
Если макрофаги не могут справиться с туберкулезной палочкой, размножение микобактерий становится неконтролируемым. Повреждения, вызванные ферментами погибших фагоцитов, становятся еще серьезнее. Это дает почву для еще большего размножения туберкулезных палочек, так как из клеток человека высвобождаются питательные вещества.
Воспалительная реакция лавинообразно распространяется на все легкие, и очаг воспаления становится похож на однородную творожистую массу из иммунных клеток, погибших клеток легких и колоний бактерий (рис. 9). В результате орган перестает исправно выполнять свою жизненно важную функцию — газообмен, и человек гибнет.
Надежды на будущее
Очевидно, что полностью ликвидировать туберкулез чрезвычайно сложно. Это связано как с трудностями диагностики и лечения заболевания, так и с отсутствием надежной вакцины, значимо снижающей вероятность заболеть. К сожалению, единственная имеющаяся сегодня на вооружении вакцина против туберкулеза — БЦЖ — далеко не всегда эффективна.
Кроме того, она, как и другие живые вакцины, время от времени становится причиной поствакцинальных осложнений. Это дает повод ученым всего мира стремиться к созданию новых препаратов. Нам остается ждать разработки новых лекарств и вакцин и надеяться, что туберкулезные микобактерии не придумают обходные пути раньше нас.
- Global tuberculosis report. (2022). WHO;
- Эргешов А.Э., Пунга В.В., Русакова Л.И., Стерликов С.А., Якимова М.А., Измайлова Т.В. (2022). Туберкулез с множественной и широкой лекарственной устойчивостью микобактерий туберкулеза в Российской Федерации. «Вестник Авиценны». 2–3, 314–319;
- Пироговская М. Чахотка в XIX веке. Arzamas;
- Marcus Vinícius Nora de Souza, Marcelle de Lima Ferreira, Alessandra Campbell Pinheiro, Maurício Frota Saraiva, Mauro Vieira de Almeida, Marcelo Siqueira Valle. (2008). Synthesis and Biological Aspects of Mycolic Acids: An Important Target AgainstMycobacterium tuberculosis. The Scientific World JOURNAL. 8, 720-751;
- S. T. Cole, B. G. Barrell. (). Analysis of the Genome ofMycobacterium tuberculosis H37Rv. Genetics and Tuberculosis. 160-177;
- David Stucki, Daniela Brites, Leïla Jeljeli, Mireia Coscolla, Qingyun Liu, et. al.. (2022). Mycobacterium tuberculosis lineage 4 comprises globally distributed and geographically restricted sublineages. Nat Genet. 48, 1535-1543;
- Julia Bespyatykh, Egor Shitikov, Ivan Butenko, Ilya Altukhov, Dmitry Alexeev, et. al.. (2022). Proteome analysis of the Mycobacterium tuberculosis Beijing B0/W148 cluster. Sci Rep. 6;
- TB risk factors. (2022). CDC;
- Edith NG Houben, Liem Nguyen, Jean Pieters. (2006). Interaction of pathogenic mycobacteria with the host immune system. Current Opinion in Microbiology. 9, 76-85;
- Marie-Laurence Lambert, Epco Hasker, Armand Van Deun, Dominique Roberfroid, Marleen Boelaert, Patrick Van der Stuyft. (2003). Recurrence in tuberculosis: relapse or reinfection?. The Lancet Infectious Diseases. 3, 282-287;
- 10 фактов о туберкулезе. (2022). ВОЗ;
- Del Puppo L., Janssens J.P., Kherad O., Younossian A.B., Frésard I. (2022). Bone tuberculosis: when consider this diagnosis?Rev. Med. Suisse.504, 262–265;
- Sayantan Ray, Supratip Kundu, Nikhil Sonthalia, Arunansu Talukdar, Khanra. (2022). Diagnosis and management of miliary tuberculosis: current state and future perspectives. TCRM. 9;
- P DONALD, H SCHAAF, J SCHOEMAN. (2005). Tuberculous meningitis and miliary tuberculosis: the Rich focus revisited. Journal of Infection. 50, 193-195;
- Thomas Els, Annerose Serr, Joachim Klisch, Eckard Oehm, Carl Hermann Lücking, Jan Kassubek. (2002). Tuberkulöse Meningoenzephalitis: klinisches Bild, Diagnostik und Behandlung. Medizinische Klinik. 97, 579-587;
- Esther M. van der Weert, Nienke M. Hartgers, H Simon. Schaaf, Brian S. Eley, Richard D. Pitcher, et. al.. (2006). Comparison of Diagnostic Criteria of Tuberculous Meningitis in Human Immunodeficiency Virus-Infected and Uninfected Children. The Pediatric Infectious Disease Journal. 25, 65-69;
- Левин А.В., Цеймах Е.А., Ананко О.Н., Зимонин П.Е., Деев Т.И., Плетнев Г.В. (2006). Использование клапанной бронхоблокации у больных с легочным кровотечением при распространенном туберкулезе. «Медланг»;
- Willem A. Hanekom, Thomas R. Hawn, Ann M. Ginsberg. (2022). Tuberculosis Vaccines. Plotkin’s Vaccines. 1095-1113.e9;
- Gregory J. Fox, Marianna Orlova, Erwin Schurr. (2022). Tuberculosis in Newborns: The Lessons of the “Lübeck Disaster” (1929–1933). PLoS Pathog. 12, e1005271;
- D. Murphy, L.A.L. Corner, E. Gormley. (2008). Adverse reactions to Mycobacterium bovis bacille Calmette–Guérin (BCG) vaccination against tuberculosis in humans, veterinary animals and wildlife species. Tuberculosis. 88, 344-357;
- БЦЖ-вакцинація у дітей та її можливі ускладнення. (2022). «Здоровье Украины. Педиатрия». 4;
- Information sheet observed rate of vaccive reactions bacille Calmette-Guerin (BCG). (2022). WHO;
- Вакцина БЦЖ. Документ по позиции ВОЗ. (2008). ВОЗ;
- Вакцина туберкулезная (БЦЖ). «Микроген»;
- Вакцина туберкулезная для щадящей первичной иммунизации (БЦЖ-М). «Микроген»;
- Разработка вакцин: чем и как имитировать болезнь?;
- Севостьянова Т.А., Аксенова В.А., Белиловский Е.М. (2022). Вакцинопрофилактика туберкулеза в мегаполисе: ее эффективность и возникающие проблемы. «Эпидемиология и вакцинопрофилактика». 3, 49–59;
- Абаев Ю.К. (2006). Хирургические осложнения вакцинации БЦЖ. «Вестник хирургии имени И.И. Грекова». 2, 122–124;
- Абаев Ю.К. (2006). Костные осложнения БЦЖ вакцинации новорожденных. «Военная медицина». 1, 81–84;
- Fine P.E.M., Carneiro I.A.M., Milstien J.B., Clements C.J., World Health Organization. (1999). Issues relating to the use of BCG in immunization programmes: a discussion document. WHO;
- Gillian F Black, Rosemary E Weir, Sian Floyd, Lyn Bliss, David K Warndorff, et. al.. (2002). BCG-induced increase in interferon-gamma response to mycobacterial antigens and efficacy of BCG vaccination in Malawi and the UK: two randomised controlled studies. The Lancet. 359, 1393-1401;
- Graham A. Colditz. (1994). Efficacy of BCG Vaccine in the Prevention of Tuberculosis. JAMA. 271, 698;
- Kwok Chiu Chang, Chi Chiu Leung. (2022). BCG Immunization: Efficacy, Limitations, and Future Needs. Handbook of Global Tuberculosis Control. 343-357;
- Naomi E. Aronson, Mathuram Santosham, George W. Comstock, Robin S. Howard, Lawrence H. Moulton, et. al.. (2004). Long-term Efficacy of BCG Vaccine in American Indians and Alaska Natives. JAMA. 291, 2086;
- Ткачук А.П., Карягина А.С., Логунов Д.Ю., Гинцбург А.Л. (2022). Перспективы создания новых вакцин для профилактики туберкулеза. «Медицинский альянс». 3, 25–37;
- Punam Mangtani, Ibrahim Abubakar, Cono Ariti, Rebecca Beynon, Laura Pimpin, et. al.. (2022). Protection by BCG Vaccine Against Tuberculosis: A Systematic Review of Randomized Controlled Trials. Clinical Infectious Diseases. 58, 470-480;
- Стукова М.А., Заболотных Н.В., Виноградова Т.И., Гергерт В.Я., Апт А.С., Капрельянц А.С. и др. (2022). Профилактика туберкулеза: современные подходы к разработке противотуберкулезных вакцин. «Вестник Российской академии медицинских наук». 11, 45–52;
- Karin Dijkman, Claudia C. Sombroek, Richard A. W. Vervenne, Sam O. Hofman, Charelle Boot, et. al.. (2022). Prevention of tuberculosis infection and disease by local BCG in repeatedly exposed rhesus macaques. Nat Med. 25, 255-262;
- J. C. Spencer, R. Ganguly, R. H. Waldman. (1977). Nonspecific Protection of Mice against Influenza Virus Infection by Local or Systemic Immunization with Bacille Calmette-Guerin. Journal of Infectious Diseases. 136, 171-175;
- J. W. WOUT, R. POELL, R. FURTH. (1992). The Role of BCG/PPD-Activated Macrophages in Resistance against Systemic Candidiasis in Mice. Scand J Immunol. 36, 713-720;
- Rob J.W. Arts, Simone J.C.F.M. Moorlag, Boris Novakovic, Yang Li, Shuang-Yin Wang, et. al.. (2022). BCG Vaccination Protects against Experimental Viral Infection in Humans through the Induction of Cytokines Associated with Trained Immunity. Cell Host & Microbe. 23, 89-100.e5;
- M. G. Netea, L. A. B. Joosten, E. Latz, K. H. G. Mills, G. Natoli, et. al.. (2022). Trained immunity: A program of innate immune memory in health and disease. Science. 352, aaf1098-aaf1098;
- Frank Liaw, Yan Yu Tan, David Hendry. (2022). Systemic BCG-osis following intravesical BCG instillation for bladder carcinoma. Clin Case Rep. 5, 1569-1572;
- Szilvia Mosolits, Bo Nilsson, Håkan Mellstedt. (2005). Towards therapeutic vaccines for colorectal carcinoma: a review of clinical trials. Expert Review of Vaccines. 4, 329-350;
- Qing Cao, Yi-Ching Chen, Chyi-Liang Chen, Cheng-Hsun Chiu. (2020). SARS-CoV-2 infection in children: Transmission dynamics and clinical characteristics. Journal of the Formosan Medical Association. 119, 670-673;
- Aaron Miller, Mac Josh Reandelar, Kimberly Fasciglione, Violeta Roumenova, Yan Li, Gonzalo H. Otazu Correlation between universal BCG vaccination policy and reduced morbidity and mortality for COVID-19: an epidemiological study — Cold Spring Harbor Laboratory;
- Uri Hamiel, Eran Kozer, Ilan Youngster. (2020). SARS-CoV-2 Rates in BCG-Vaccinated and Unvaccinated Young Adults. JAMA. 323, 2340;
- Reducing health care workers absenteeism in Covid-19 pandemic through BCG vaccine (BCG-CORONA). (2020). US National Institute of Health;
- Jop Vrieze. (2020). Can a century-old TB vaccine steel the immune system against the new coronavirus?. Science;
- Bacillus Calmette-Guérin vaccine supply & demand. (2022). UNICEF;
- BCG vaccine global market study. (2022). WHO;
- Вопросы и ответы о противотуберкулезных вакцинах. (2022). ВОЗ;
- GSK’s Investigational Vaccine Candidate M72/AS01E shows promise for prevention of TB disease in a Phase 2b trial conducted in Kenya, South Africa and Zambia. (2022). WHO;
- Кох и все его палочки;
- Болезнь, не думавшая сдаваться;
- Липидный фундамент жизни;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Иммунитет: борьба с чужими и… своими;
- Главный «почвенник» медицины: Зельман Ваксман;
- Найти и заменить: существует ли альтернатива пробе Манту;
- M.C. Raviglione, H.L. Rieder, K. Styblo, A.G. Khomenko, K. Esteves, A. Kochi. (1994). Tuberculosis trends in Eastern Europe and the former USSR. Tubercle and Lung Disease. 75, 400-416;
- «Кровавая» работа врачей, ученых и природы;
- Luis E. Escobar, Alvaro Molina-Cruz, Carolina Barillas-Mury. (2020). BCG vaccine protection from severe coronavirus disease 2022 (COVID-19). Proc Natl Acad Sci USA. 117, 17720-17726;
- 2022-nCoV: очередной коронованный убийца?;
- COVID-19: отвечаем на вопросы;
- COVID-19: что мы знаем и чего не знаем;
- Luke A. J. O’Neill, Mihai G. Netea. (2020). BCG-induced trained immunity: can it offer protection against COVID-19?. Nat Rev Immunol. 20, 335-337;
- Что такое ДНК-вакцины и с чем их едят?.
Новые вакцины
Бесспорно, вакцина БЦЖ спасла множество жизней, но нельзя отрицать, что ее эффективность оставляет желать лучшего.
Активная работа по созданию новых вакцин против туберкулеза ведется давно, но, к сожалению, пока не привела к практическим результатам. Требования к вакцинам-кандидатам высоки: они должны вызывать стойкий специфический иммунитет, иметь минимум побочных эффектов и низкую цену.
Последнее особенно актуально, учитывая, что 80% всех новых случаев туберкулеза приходится на бедные страны. Кроме того, новые вакцины должны эффективно защищать все группы населения: как ранее вакцинированных людей, так и инфицированных микобактериями туберкулеза и/или ВИЧ, и предупреждать реактивацию латентной формы туберкулеза.
Сегодня существует три основных направления разработки новых противотуберкулезных вакцин.
Во-первых, ученые стремятся модифицировать уже известные на сегодня вакцинные штаммы БЦЖ, добавляя в них рекомбинантные антигены микобактерий туберкулеза либо вещества, стимулирующие иммунный ответ (адъюванты).
Во-вторых, большие надежды возлагались на ДНК-вакцины[69]. Их разработка связана с введением нуклеотидных последовательностей, кодирующих определенные антигены патогена, в состав специальной генетической конструкции. Такие препараты весьма перспективны, но в сравнении с цельноклеточными вакцинами обладают значительно меньшей иммуногенностью и нуждаются в особых условиях хранения.
Среди ДНК-вакцин больше всех продвинулась вакцина MVA85A (Modified Vaccinia Ankara, консорциум «Оксфорд-Эмерджент»). Это — ген белка 85А туберкулезной микобактерии, вставленный в генетическую конструкцию на основе генома поксвируса.
При введении вакцины происходит синтез антигена, закодированного в гене 85А. В 2022 году прошли клинические испытания MVA85A в Южной Африке. Исследование проводили на нескольких тысячах ранее вакцинированных БЦЖ 4–6-месячных детей. Половина из них получила одну дозу вакцины, а остальные — плацебо (препарат, несущий вместо антигена палочки Коха белок, не имеющий к ней никакого отношения).
В результате были продемонстрированы безопасность и хорошая переносимость нового препарата. Эффективность же вакцины составила всего 17,3%. Возможно, это связано не с тем, что вакцина плоха, а с тем, что дети уже имели иммунитет к туберкулезу, обусловленный действием вакцины БЦЖ [52].
Самый широко распространенный класс разрабатываемых вакцин против туберкулеза — субъединичные, то есть состоящие из полученных генно-инженерным способом очищенных бактериальных белков. Такие препараты наиболее перспективны, поскольку содержат антигены с известными свойствами, а также лишены посторонних белков, которые могут вызывать побочные эффекты.
В НИИ особо чистых биопрепаратов ФМБА в России закончены доклинические исследования вакцины-кандидата на основе рекомбинантных белков TB10.4 и Ag85B палочки Коха. В ближайшее время ученые планируют перейти к клиническим испытаниям.
Особые надежды ВОЗ возлагает на субъединичную вакцину M72/AS01E, она находится в фазе клинических испытаний. Основа этой вакцины — связанные с адъювантом AS01E два антигена микобактерий туберкулеза. Результаты испытаний в Замбии, Кении и Южной Африке показали, что введение двух доз M72/AS01E снижает риск развития туберкулеза более чем в два раза.
Решающий шаг на пути к созданию вакцины
Дифтерийный токсин — страшное оружие. Но и его можно обезвредить: под воздействием формальдегида он теряет ферментативную активность и больше не может связываться с клетками, но сохраняет иммуногенность — способность вызывать иммунный ответ. Так получают анатоксин, или токсоид, который в наши дни используют для иммунизации против дифтерии.

Рисунок 6. Французский ветеринар и биолог Гастон Рамон, впервые получивший дифтерийный анатоксин. Благодаря ему миллионы детей (и нынешних, и уже выросших) оказались защищенными от дифтерии и столбняка. Рамон был 155 раз номинирован на Нобелевскую премию и ни разу ее не получил.
[29]
Тем не менее за современную вакцину пришлось еще побороться. В 1948 году в Киото произошла трагедия: из 606 вакцинированных детей 68 умерли из-за того, что токсоид снова превратился в токсин. Случилось это из-за неправильного изготовления препарата.
Важно понимать, что прививка от дифтерии направлена именно против бактериального токсина — это значит, что привитые люди могут быть носителями опасных бактерий. Для тех, кто отказывается от вакцинации именно своего ребенка в надежде на то, что все остальные дети и взрослые привиты, это плохая новость: такая стратегия не сработает. Опасная больная бактерия может быть рядом, просто не показывается до поры до времени.

Рисунок 7. Основные вехи в истории борьбы с дифтерией.В 1613 году в Испании разразилась очередная эпидемия дифтерии, год вошел в историю страны как «год удавочки». В 1826 году французский врач Пьер Бретонно дал болезни современное название и впервые провел трахеостомию. В 1883 году немецкий бактериолог Эдвин Клебс идентифицировал возбудителя дифтерии — бактерии C. diphtheriae. В 1890 году микробиолог и гигиенист Фридрих Лёффлер показал, что бактерии продуцируют дифтерийный токсин, а уже через четыре года после этого (1894 год) появились первые свидетельства успешного применения лошадиного антитоксина в США. В 1948 году в Киото из-за неудачи в изготовлении дифтерийной вакцины умирли 68 детей. Работа ученых продолжилась — в 1951–1953 гг. В. Фриман показал, что для выработки дифтерийного токсина бактерии должны быть заражены фагами. Программа всемирной вакцинации против дифтерии, в свою очередь, стартовала в 1974 году. В 2003 году ученые расшифровали последовательность генома дифтерийной палочки, в 2006 году на рынок вышла первая пентавалентная вакцина. При этом эпидемии дифтерии продолжаются до сих пор: если в середине XX века (1943 год) дифтерия уносила жизни десятков тысяч человек в Европе (последняя крупная эпидемия в России произошла в 1994 году), то в последние годы болезнь заявляет о себе в Венесуэле, Гаити, Индонезии, Бангладеш и Йемене.
иллюстрация Ирины Ефремовой по [30], The history of vaccines
Фимбрии и пили.
Кроме жгутиков, клетки бактерий могут иметь длинные, тонкие и прямые нити — фимбрии. Фимбрии значительно короче и тоньше жгутиков, но более многочисленны. Обнаружены они как у подвижных, так и у неподвижных организмов. Длина фимбрии составляет 1,5 мкм, диаметр — 7 нм. На одну бактериальную клетку обычно приходится 50—400 фимбрий. Они располагаются по всей поверхности клетки и состоят из белка — пилина.
Известно уже несколько типов фимбрий, которые различаются функциями. Наиболее изучены функции фимбрий первого и второго типов. Фимбрии первого типа характерны для многих бактерий, в связи с чем их называют фимбриями общего типа. Наличие фимбрий первого типа помогает бактериальной клетке прилипать к клеткам живых организмов (эритроцитам и другим клеткам животных и человека, к клеткам растений и грибов) и неорганическим субстратам или способствует образованию пленок на поверхности жидкостей, в которых протекает жизнедеятельность бактерий. Считают, что фимбрии данного типа служат органами прикрепления (рис. 17).

Рис. 17. Клетка Escherichia coli, окруженная фимбриями.
Электронная микрофотография
Большой интерес представляют фимбрии второго типа, так называемые половые фимбрии, или F-пили, имеющие внутри канал, через который передается генетический материал от одной клетки к другой при конъюгации бактерий. Половые пили представляют собой белковые цилиндры толщиной 8,5—9,5 нм и длиной до 1,1 мкм. Полагают, что F-пили обеспечивают контакт между двумя клетками и служат конъю- гационной трубкой, по которой происходит передача ДНК. Через пили в клетки бактерий могут проникать вирусы (фаги). Фимбрии не считают обязательной структурой бактериальной клетки, так как без них бактерии могут нормально расти и размножаться.
На поверхности клеток некоторых бактерий, близких к псевдомонадам, обнаружены своеобразные структуры, так называемые шипы. Они представляют собой полые цилиндры длиной 1—3 мкм и толщиной около 65 нм. Шипы состоят из белка спинина. Бактерии с шипами обычно неподвижны. Считают, что образование шипов способствует лучшему выживанию бактерий в естественной среде обитания. У ряда метилобактерий обнаружены трубчатые выросты, число которых может достигать 300—350. Диаметр трубочек около 40 нм, длина до 0,3 мкм. Основание трубочки связано с клеточной стенкой бактерии, но под трубочкой имеется канал, который достигает цитоплазматической мембраны. Значение трубчатых выростов для жизнедеятельности бактерий остается пока не выясненным.
Клеточная стенка — один из главных элементов структуры бактериальной клетки. Клеточная стенка обладает определенной ригидностью, т. е. жесткостью, и вместе с тем эластичностью — может изгибаться. Ее можно разрушить ультразвуком, ферментом лизоцимом и другими способами. В случае разрушения клеточной стенки содержание клетки — цитоплазма с включениями, окруженная цитоплазматической мембраной, — приобретает шаровидную форму. Такую округлившуюся клетку, образовавшуюся после удаления клеточной стенки у бактерии, называют протопластом, а если оболочка разрушена не полностью — сферопластом. Отсюда следует, что стенка придает бактериальной клетке определенную форму.
Клеточная стенка имеет и другие функции. Она защищает внутреннее содержимое клетки от действия механических и осмотических сил внешней среды, ей принадлежит важная роль в регуляции роста и деления бактерий, распределении генетического материала.
Толщина клеточной стенки колеблется от 20 до 100 нм и более и составляет около 20 % сухого вещества бактериальной клетки. Клеточная стенка относительно проницаема для крупных молекул. Она связана с цитоплазматической мембраной соединительными тяжами — «мостиками».
Считают, что клеточная стенка ответственна за окрашивание бактерий по Граму[1], так как способность или, наоборот, неспособность окрашиваться по Граму связана с различием в химическом составе клеточных стенок бактерий.
Главным структурным компонентом клеточных стенок большинства исследованных бактерий служит пептидогликан, или муреин, представляющий собой гетерополимер, который построен из чередующихся остатков КГацетил-]Ч-глюкозамина и N-ацетилмурамовой кислоты (З-О-лактил-К-ацетил-Ы-глюкозамин), соединенных 13-1,4- связями, и небольшой группы аминокислот: L-аланина, D-аланина, D-глутаминовой кислоты, а также лизина или диаминопимелиновой кислоты.
Молекула пептидогликана представляет собой правильную сеть из параллельно расположенных полисахаридных цепей, соединенных друг с другом короткими цепями пептидов. Пептидогликан обладает прочностью и упругостью, при растворении других компонентов клетки он сохраняет форму, образуя своеобразный пептидогликано- вый, или муреиновый, мешочек, или саккулу, которая состоит из сетки муреиновых молекул.

Пептидогликан придает клеточной стенке ригидные свойства, благодаря чему бактериальная клетка способна сохранять форму. У грам- положительных бактерий клеточная стенка состоит главным образом из многослойного пептидогликана, с которым соединены вторичные полимеры — тейхоевые кислоты (полимеры, образованные остатками спирта рибита или глицерина, связанными фосфодиэфирными мостиками) и тейхуроновые кислоты, образованные остатками уроновых кислот и N-ацетилглюкозамина.
Большинство грамположительных бактерий имеет в составе клеточной стенки дополнительные структуры, образованные полисахаридами, белками или гликопротеидами, участвующими в защите клетки от внешних воздействий. У грамположительных бактерий пептидогликан обычно составляет 40—60 % сухой массы клеточной стенки, у некоторых видов — 80—90 %. Обычная для многих бактерий толщина клеточной стенки в 30—40 нм соответствует толщине приблизительно 40 молекул пептидогликана.
Отличительная особенность клеточной стенки грамотрицательных бактерий — наличие так называемой наружной мембраны. Наружная мембрана состоит из фосфолипидов, липополисахарида (ЛПС), липопротеина (ЛП) и белков. Под наружной мембраной расположена периплазма, или периплазматическое пространство. Периплазма содержит один слой пептидогликана и раствор, в состав которого входят специфичные для нее белки и олигосахариды, а также неорганические соединения. Пептидогликан грамотрицательных бактерий составляет около 10 % массы клеточной стенки. Толщина слоя пептидогликана обычно не превышает 1,6—3 нм, а поскольку толщина мономолекуляр- ного слоя пептидогликана около 1 нм, следует предположить, что пептидогликан в периплазме образует несколько слоев.
Таким образом, неодинаковое отношение бактерий к окраске по Граму может быть объяснено различием в количестве пептидогли- кана и его локализацией в клеточной стенке.
Клеточной стенки нет у микоплазм, а также у L-форм бактерий. Обычно как L-формы обозначают бактерий, способных к нормальному развитию при отсутствии клеточной стенки. Наименование «L-формы» (от названия Листеровского института в Великобритании, где были впервые изучены) получили бактерии, полностью или частично лишенные клеточной стенки. Переход бактерий в L-форму осуществляется под действием различных факторов (антибиотиков, например пенициллина, или спонтанно, без видимой причины), нарушающих структуру и синтез клеточной стенки.
В культуре L-формы можно обнаружить клетки размером 0,2— 50 мкм. В связи с отсутствием клеточной стенки у L-форм нет определенной формы и не функционируют нормальные механизмы клеточного деления. Поэтому в колониях этих организмов обычно обнаруживают так называемые элементарные тела размером 0,2—1 мкм, шаровидные тела размером 1—5 мкм, большие тела размером 5—50 мкм, нитевидные структуры различного диаметра, а также бесструктурные массы, в которых границы отдельных клеток не видны. Считают, что образование L-форм происходит не только в лабораторных, но и в природных условиях, причем к образованию L-форм способны многие бактерии — как патогенные, так и сапротрофные.
Интересно отметить, что, хотя бактерии в L-форме менее активны, чем в нормальном состоянии, они совершенно нечувствительны к факторам, влияющим на клеточную стенку, в частности устойчивы к целому ряду антибиотиков. По-видимому, переход в L-форму необходимо рассматривать как способ переживания бактериями неблагоприятных условий.
Эффективность бцж
Наиболее спорный вопрос при обсуждении БЦЖ — это ее эффективность. В различных клинических испытаниях данные о ней существенно разнятся и зависят от количества человек в выборке, а также места проведения исследования. Так, исследования, проводимые в Европе, последовательно показывают защитный эффект вакцинации на уровне 60–80%, но те, что проводились в странах Африки, не фиксируют никакого эффекта.
Эффективность вакцин от туберкулеза, судя по всему, зависит от географического положения территории — на экваторе эффективность в среднем ниже, чем в средней полосе [30]. Вероятно, это связано с тем, что в жарком климате живет больше нетуберкулезных микобактерий (например, M. avium, M. marinum и M. intracellulare), которые имеют схожие с палочкой Коха и БЦЖ антигены и поэтому играют роль природной «вакцины» [31].
В наших широтах БЦЖ снижает риск заболеть туберкулезом примерно на 50% [32]. Некоторые ученые считают, что причина различной эффективности БЦЖ в разных странах кроется также в разнообразии вакцинных штаммов или генетических особенностях людей разных национальностей. Была даже прослежена связь заболеваемости с группой крови .
У БЦЖ есть и другие недостатки. Например, вакцина БЦЖ не предотвращает первичного инфицирования и не исключает, хотя и снижает, вероятность реактивации латентного туберкулеза, основного источника распространения болезни.
Вакцина БЦЖ производится не из M. tuberculosis, а из другого вида микобактерий — M. bovis, — и поэтому в ней нет некоторых важнейших антигенов туберкулезной палочки, которые характерны исключительно для нее (но не для других микобактерий) [33].
Одной из самых острых проблем вакцины является то, что иммунитет, сформированный БЦЖ, со временем сильно снижается и через 7–25 лет практически исчезает. Повторное введение БЦЖ (ревакцинация) помогает далеко не всегда, поскольку иммунная система к этому времени уже «привыкает» к постоянному контакту с различными микобактериями.
По мнению ученых [37], причина недостаточной эффективности БЦЖ кроется в особенностях иммунного ответа на эту вакцину. Как мы помним, при первичном заражении туберкулезом первыми на помощь приходят клетки врожденного иммунитета, которые выделяют всевозможные сигнальные молекулы, активирующие адаптивный иммунитет. При введении БЦЖ происходит то же самое.
В результате вакцинации в организме появляются Т-клетки, которые «помнят врага в лицо» и могут быстро запустить иммунный ответ при повторном появлении палочки Коха. Это так называемые T-клетки памяти. Они бывают нескольких типов: долгоживущие «центральные» и относительно короткоживущие «эффекторные».
Если основная функция «эффекторных» T-клеток — быстро передать сигнал об атаке патогеном другим иммунным клеткам, тем самым запустив иммунный ответ, то «центральные» способны уничтожать патоген собственными силами. Так вот, при вакцинации или инфекции микобактериями туберкулеза вырабатываются первые, которые по прошествии 20 лет отмирают «за ненадобностью»; образование же вторых, «центральных», для туберкулеза не доказано.
Таким образом, миру необходимо разработать новую вакцину (или поработать над старой), такую, чтобы она мобилизовала более «долгоиграющие» T-клетки памяти и активировала больше уровней иммунитета, чем современная БЦЖ. Такая вакцина будет более надежно и долго защищать организм от туберкулеза.
С другой стороны, БЦЖ не стоит недооценивать. Пусть она не может полностью защитить от туберкулеза, вакцина заметно снижает риск развития осложнений (частота случаев туберкулезного менингита после внедрения БЦЖ снизилась на 73%). Кроме того, уже давно известно, что живые вакцины против туберкулеза и кори обладают «перекрестной защитой», то есть способны защищать от широкого круга заболеваний.
Как бы то ни было, мировой спрос на вакцину продолжает расти: если в 2022 году он составлял 152,2 млн доз [50], то уже в 2022 году достиг отметки в 325 млн доз [51]. Это говорит о том, что, пока туберкулез не ликвидирован, человечество будет нуждаться в вакцине, будь то БЦЖ или новый, более действенный препарат. В связи с этим, сегодня особую роль в профилактике туберкулеза играет поиск новых противотуберкулезных вакцин.

